近日,我校生命科学研究院王炜副研究员作为通讯作者之一,联合多家单位在《蛋白和细胞》(Protein&cell)在线发表了题为“Crystal structure of monkeypox H1 phosphatase, an antiviral drug target”的研究成果,报道了引发今年全球猴痘疫情毒株的首个潜在药物靶点的高分辨率三维结构,为抗猴痘病毒特异性治疗药物的研发提供了重要理论基础。

作为天花病毒的近亲,猴痘病毒自今年5月起在全球范围内迅速传播,截至目前,已感染近8万人,波及100多个国家和地区,已被世界卫生组织认定为国际关注的突发公共卫生事件,给新冠疫情下的世界带来新挑战。猴痘病毒感染可导致发热、特征性皮疹和淋巴结肿大等症状。目前天花疫苗和抗天花药物已被紧急批准应用于猴痘病毒的防治,但尚缺少针对猴痘病毒的特异性药物。
猴痘病毒属于痘病毒科、正痘病毒属,是一种大型双链DNA病毒,其基因组约200kb,编码约200种蛋白。其中一些蛋白参与病毒复制的关键步骤,保证病毒自身复制的顺利进行;另一些蛋白负责拮抗宿主的免疫响应,实现免疫逃逸。这些蛋白是病毒复制所必需的,可作为潜在的药物靶点。病毒编码的双特异性磷酸酶H1是病毒对抗宿主的一种强有力的“武器”。H1在病毒进入细胞后被释放到细胞质中,通过去除宿主STAT1蛋白的磷酸化修饰,抑制干扰素信号通路,从而下调宿主细胞的抗病毒反应,为病毒复制创造适合的细胞内环境。已有报道发现针对痘苗病毒磷酸酶H1的小分子抑制剂可有效在细胞水平抑制病毒复制。因此,磷酸酶H1是具有潜力的抗猴痘病毒药物靶点。
为了深入研究猴痘病毒磷酸酶H1的生物学功能机制,王炜团队表达提纯了高纯度的磷酸酶H1蛋白,并通过X射线晶体学技术手段捕获到了磷酸酶H1在催化反应终产物(磷酸根)释放前的状态的高分辨率(1.8 Å)三维结构。他们发现,H1蛋白通过N端的α螺旋与另一个H1分子形成二聚体,形似蝴蝶。H1的酶活性中心位于最后一个β折叠的C端附近,主要包含一个催化三联体-Asp79、Cys110和Arg116。通过对活性口袋中磷酸根与周围氨基酸的相互作用分析,揭示了活性中心关键氨基酸在去磷酸化反应中的关键功能。
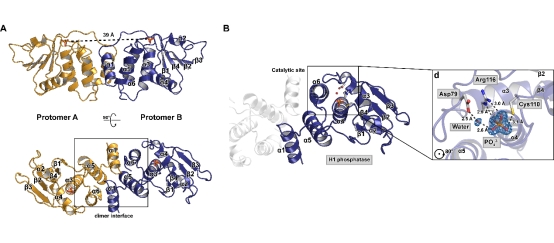
猴痘病毒双特异性磷酸酶H1的三维空间结构
(A) H1整体结构以及二聚化界面;(B) H1活性中心
此项工作解析了引发今年全球猴痘疫情毒株的首个潜在药物靶点的高分辨率三维结构,揭示了其发挥催化功能的结构基础,并发现了两个重要的药物开发位点:一个是H1磷酸酶的二聚体界面,而另一个是其活性中心。为针对猴痘病毒的特异性治疗药物的研发提供了重要理论依据。
重庆医科大学生命科学研究院博士后崔闻、博士研究生黄浩峻,上海科技大学博士研究生段胤凯为本论文的并列第一作者。上海科技大学免疫化学研究所和生命科学与技术学院杨海涛教授、南京大学生命科学学院籍晓云教授、我校王炜副教授为共同通讯作者。晶体衍射数据收集得到上海同步辐射光源和国家蛋白质(上海)设施的帮助。本项研究得到了科技部国家重点基础研究发展计划,国家自然科学基金等项目支持。
原文链接:https://doi.org/10.1093/procel/pwac051